
et de Cancérologie du Pont Saint Vaast
RECHERCHE CLINIQUE
La recherche clinique à Léonard de Vinci
Le champ d’application de l’oncologie est en expansion : de nouveaux outils apparaissent régulièrement : Le CENTRE LEONARD DE VINCI possède des moyens techniques innovants, grâce à une actualisation régulière : IRM, VMAT .. (voir page dédiée)
Et en participant aux phases de développement de nouvelles stratégies thérapeutiques : les ESSAIS CLINIQUES.
Le CENTRE LEONARD DE VINCI est actuellement ouvert au recrutement, pour des essais et observatoires, dans diverses pathologies : sein, ORL, digestif, gynécologie .. (phases : IIb, III, IV, )
Partenariat avec les promoteurs d’essai clinique :
-
Industriels : grands groupes pharmaceutiques (ROCHE, PFIZER, IPSEN, MERCK, NOVARTIS, BOEHRINGER …)
-
Institutionnels : sociétés savantes, centres de lutte contre le cancer (Centre Oscar Lambret, GORTEC, FFCD, FNCLCC, …)
Le médecin qui vous suit à LEONARD DE VINCI, oncologue, radiothérapeute, peut donc être médecin investigateur d’un essai clinique, et vous proposer d’y être inclus. Pour cela:
-
Votre état de santé doit être en adéquation avec le protocole : caractéristiques de la maladie, antécédents, traitements en cours, et ou déjà reçus (critères d’inclusions / d’exclusion).
-
Vous recevez de la part du médecin toutes les explications concernant le protocole : bénéfice attendu, contraintes, autres stratégies possibles .. et pouvez lui poser toutes vos questions.
-
La balance bénéfice / risque doit être en votre faveur.
-
Vous recevez une notice d’information, et un consentement éclairé que vous signerez conjointement avec le médecin investigateur selon les bonnes pratiques cliniques.
-
Vous pouvez être reçu par l’attachée de recherche clinique, qui vous détaillera les modalités de votre prise en charge, et vous assistera pour le planning de vos soins et de vos examens complémentaires.
Pour plus d'information sur ce qu'est un "Essai Clinique" n'hésitez pas à consulter le site "Notre Recherche Clinique" en cliquant sur le lien suivant :
Vos droits, vos devoirs
-
Vous êtes libre de renoncer à l’essai clinique à tout moment sans conséquence : le médecin envisagera alors avec vous les autres possibilités thérapeutiques
-
En approuvant votre inclusion, vous acceptez les recommandations, et le planning prévus au protocole, ainsi que le recueil anonymisé des données de votre dossier médical.
-
Vous bénéficiez d’un suivi adapté et rigoureux.
La recherche clinique: Pourquoi, comment ?
La recherche clinique est un moteur indispensable du progrès médical.
Dans le cadre de la cancérologie, les « essais cliniques » ou « études cliniques » portent sur plusieurs domaines : le dépistage, les examens de diagnostic, la surveillance, les techniques de traitement (chirurgie, radiothérapie ..), les médicaments et combinaisons de médicaments, la prévention et le traitement des effets secondaires …
Pour plus d'information sur ce qu'est un "Essai Clinique" n'hésitez pas à consulter le site "Notre Recherche Clinique" en cliquant sur le lien suivant :
Les différentes phases d'essais cliniques
Après la phase préclinique (en laboratoire) qui permettent d’évaluer l’activité d’un produit et sa toxicité, les chercheurs passent aux essais cliniques, c’est-à-dire chez l’Homme. Les essais cliniques se déroulent en plusieurs étapes afin de garantir la sécurité des malades.
-
Les essais de phase I : évaluation de l’action de la molécule sur l’organisme, et détermination de la dose recommandée. Cette étape concerne un petit nombre de patients et est réalisée dans des centres spécialisés.
-
Les essais de phase II : évaluation de l’activité anti tumorale du traitement et détermination du mode d’administration. Le nombre de patients inclus est un peu plus important.
-
Les essais de phase III : comparaison de la molécule au traitement de référence, ou en complément du traitement de référence. Ces essais peuvent aussi comparer les traitements en termes d’efficacité, de tolérance, de coût, de durée, de profil de malade …. Ils concernent de grands groupes de patients, recrutés dans plusieurs centres, au niveau international, pour évaluer le service médical rendu (SMR) Si les résultats sont favorables, le traitement pourra faire l’objet d’une demande d’autorisation de mise sur le marché (AMM) afin d’être commercialisé.
-
Les essais de phase IV : une fois le traitement commercialisé il fait encore l’objet d’une surveillance appelé pharmacovigilance.Ces essais portent sur des cohortes très importantes de patients, et dans le cadre « de la vraie vie », permettant d’alerter sur tout signe anormal inattendu.
Les Essais
Actuellement, il existe plusieurs essais cliniques en cours au Centre Léonard De Vinci
Essais dans le cancer du sein :
- RxPONDER
- Le traitement du cancer du sein est orienté en fonction du type de cancer. De nombreux paramètres influent sur la décision thérapeutique : la présence ou de non de recepteurs hormonaux, la positivité ou pas des recepteurs Her2, le type histologique, e TNM (classification T= taille tumorale, N = présence ou non de ganglions envahis, M = présence ou pas de métastases)
- Un nouveu test, nommé Oncotype DX®, développé par Genomic Health, permet d'évaluer, en cas de cancer du sein, le niveau de mutation des gènes afin de savoir si la chimiothérapie va apporter un bénéfice ou pas au cas par cas.
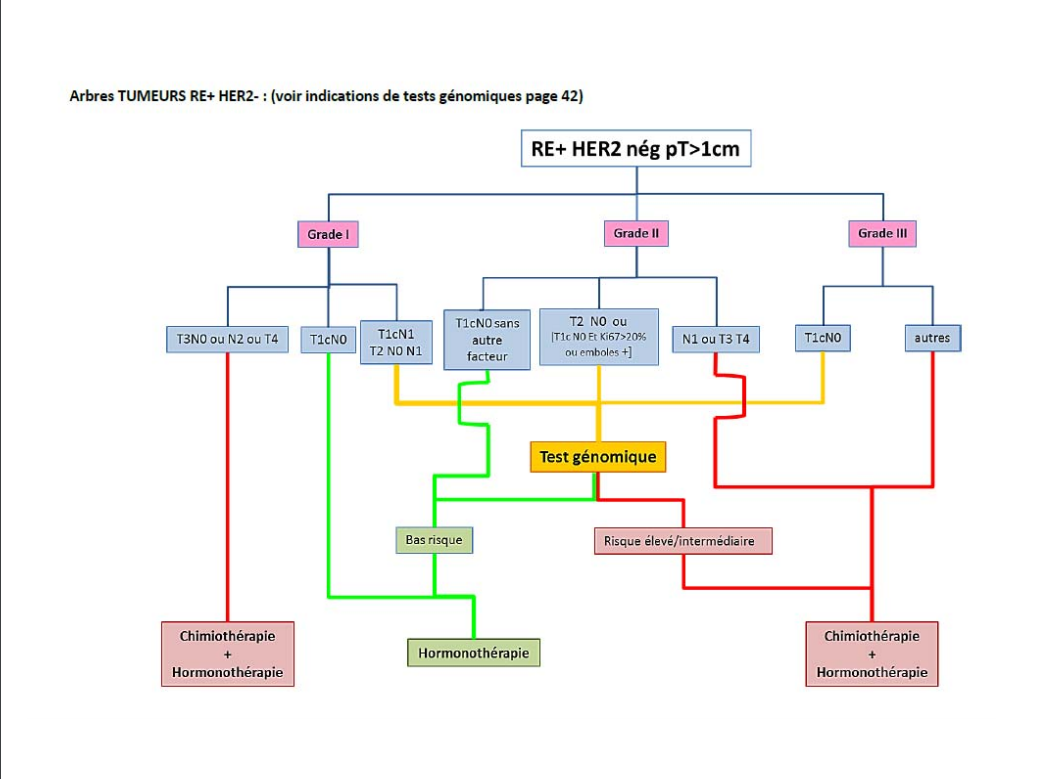
L'utilisation de ce test est désormais pratique courante pour les patients N0, c'est à dire sans envahissement ganglionnaire
2016 : 19 patientes ont bénéficié du test Oncotype, et pour 11 d'entre elles le traitement par chimiothérapie n'a pas été retenu en raison du score faible
2017 : 29 patientes ont bénéficié du test Oncotype, et pour 18 d'entre elles le traitement par chimiothérapie n'a pas été retenu en raison du score faible
- Etude "RxPonder" (Etude de phase III randomisée) : dont l'objectif est de déterminer le bénéfice ou non de la chimiothérapie chez des patientes N+, c'est à dire ayant 1 à 3 ganglions envahis, et ayant un reccurence score inférieur à 25.
- L'ouverture de cet essai à Léonard de Vinci à permis d'inclure en 2016 et 2016 un total de 21 patientes.
- Seules 2 avaient un score supérieur à 25, ne laissant aucun doute sur la plce de la chimiothérapie, et 2 autres ont souhaité quitter l'esai.
- Sur les 17 patientes "randomisées", 11 l'ont été dans le bras HORMONOTHERAPIE SEULE.
- En pratique : une analyse complémentaire des lames de votre exérèse (mastectomie ou mammectomie) est réalisée aux USA, les résultats sont ensuite envoyés sous une quinzaine de jours à votre oncologue. Et en fonction de ses résultats votre oncologue validera l'interêt ou non d'une chimiothérapie adjuvante.
Lexique
-
Attaché de recherche clinique : Assiste le médecin investigateur, recueille et contrôle les données, suit l’étude clinique et le respect du protocole.
-
C.P.P. : Comité de Protection des Personnes qui se prêtent à la recherche biomédicale. Dans chaque région ce comité se réunit régulièrement, il examine les projets d’études, vérifie que ceux-ci respectent les droits des patient(e)s. Après cet examen, il rend obligatoirement un avis écrit sur l’étude. Celle-ci ne peut débuter sans l’autorisation du comité.
-
Consentement éclairé : Formulaire propre à l’étude qui sera signé par le médecin et le patient pour permettre sa participation à l’étude.
-
Eligibilité : L'éligibilité caractérise la possibilité pour un patient d'être inclus dans un essai s'il répond aux critères d'inclusion (et de non inclusion) dans l'essai. Le patient est alors dit "éligible pour l'essai".
-
Investigateur : Selon la loi Huriet, l'investigateur d'un essai clinique est forcément un médecin qui dirige et surveille la réalisation de la recherche biomédicale (article L1121-3 du Code de la Santé publique). Ce médecin doit justifier d'une expérience appropriée Médecin qualifié, responsable sur un site du recrutement, de l’information, de l’obtention du consentement, de l’inclusion, du suivi, ainsi que du recueil des données, de la surveillance des patient(e)s et de la gestion des effets indésirables dans un essai thérapeutique.
-
Loi Huriez-Sérusclat de 1988 : (modifiée par la loi de santé publique du 9 aout 2004, et amendée par la loi Jardé en 2012): Texte de loi qui a pour objet d’organiser la recherche et de garantir la protection des personnes.
-
Note d’information : Formulaire destiné au patient, propre à l’étude qui décrivit son déroulement, ses contraintes, ses bénéfices.
-
Observations : Décrit les cahiers d'observations utilisées dans un essai clinique pour recueillir les informations concernant les sujets ou les patients inclus dans l'essai. (ces données sont anonymes)
-
Ouvert au recrutement : lorsqu’un centre, et les investigateurs ont obtenu les autorisations réglementaires pour le recrutement et que la mise en place de l’essai a été réalisée (formation des investigateurs et du personnel dédié)
-
Procédures opératoires : Une procédure opératoire standard présente par écrit le détail des actions à réaliser lors d'une mesure à effectuer ou d'une décision à prendre dans un protocole de recherche. L'avantage d'une POS est qu'elle incite tous les investigateurs à travailler de la même façon et qu'elle leur évite des oublis malencontreux. Toutes sortes de POS peuvent être écrites dans la recherche biomédicale concernant aussi bien les responsabilités du promoteur, des ARC, des investigateurs, des auditeurs et des inspecteurs. Les POS doivent être régulièrement mises à jour, datées et signées par la personne responsable de leur rédaction.
-
Promoteur : Personne (médecin, scientifique non-médecin) ou organisation (firme pharmaceutique, organisme de recherche, hôpital, association) qui prend l’initiative de la recherche depuis le circuit du médicament jusqu’à la publication du rapport d’étude. Il assume la responsabilité du lancement, de la gestion, du financement de l’essai clinique et a la charge des contraintes technico-réglementaires, dont l’assurance en responsabilité civile.
-
Protocole : Document détaillant le projet de recherche et devant donner le maximum d’indications utiles à l’investigateur en cas d’événement survenant durant l’essai (arrêt prématuré du traitement, sortie d’essai, effet indésirable…).
-
Randomisation : Attribution par tirage au sort d'un des traitements de l'étude une fois l'accord de participation obtenu.
- Service médical rendu : La commission de la Transparence a la responsabilité, en France, d'évaluer le service médical rendu (SMR) de chaque nouveau médicament qui demande un remboursement par la Sécurité sociale. Le SMR est évalué dans la pathologie qui correspond à l'indication thérapeutique du médicament telle qu'elle a été validée par l'AMM. La commission évalue également l'amélioration du SMR (dite ASMR) par rapport aux médicaments déjà validés dans l'indication, et classe l'ASMR du nouveau médicament de 1 (amélioration maximum) à 6 (absence totale d'amélioration).
- Traitement de référence : Traitement le plus efficace actuellement disponible dans le commerce.
Pour toute questions, vous pouvez contacter:
